内容
介绍
人类基因组测序于2003年完成,经过13年的国际合作和三十亿美元的投资。人类基因组计划中使用桑格测序(尽管大量优化),自20世纪70年代发明的DNA测序的主要方法。
今天,用于测序的需求呈几何级数增长,与需要大量的基因组DNA进行快速分析,廉价地和准确。多亏统称为下一代测序新的测序技术,现在有可能在几个小时内测序整个人基因组。
Sanger测序和新一代测序
后面下一代测序(NGS)的原理是类似的的Sanger测序,这依赖于毛细管电泳。基因组链被分段,并且在每个片段的碱基被发射的信号来识别时的片段针对模板链连接。
需要用于测序单独的步骤,分离(通过电泳)和检测该Sanger法,这使得它难以自动化样品制备,它是在通过量,可扩展性和分辨率的限制。该NGS方法使用结合在Sanger测序开发来处理百万反应平行,导致非常高的速度,并可以通过在降低成本的技术的基于阵列的测序。那花了很多年,桑格方法的基因组测序项目,现在可以在NGS小时内完成,虽然较短读长(那在时间序列碱基数),少的准确性。
DNA测序的新一代方法有三个基本步骤:
- 文库制备:库使用DNA的随机片段创建,接着用自定义接头结扎
- 放大:该库是用克隆扩增的方法和扩增PCR
- 测序:DNA被使用几种不同方法之一进行测序
图书馆准备
首先,DNA被两种酶或通过超声处理(激励用超声波),以创建更小股线分段。然后适配器(合成DNA的短双链件)被连接到这些片段用DNA连接酶的帮助下,联接的DNA链的酶。适配器使序列成为结合到互补配对。
适配器被合成,使一端是“粘性”,而另一种是'钝'(非粘性),以期加入钝端的钝端DNA。这可能导致分子,因此形成二聚体之间的碱基配对的潜在的问题。为了防止这种情况,DNA的化学结构被利用,因为结扎开出的3'-OH和5'-P结束之间进行。通过从适配器的粘性末端除去磷酸盐和因此建立一个5'-OH端相反,DNA连接酶是无法形成两个末端之间的桥(图1)。
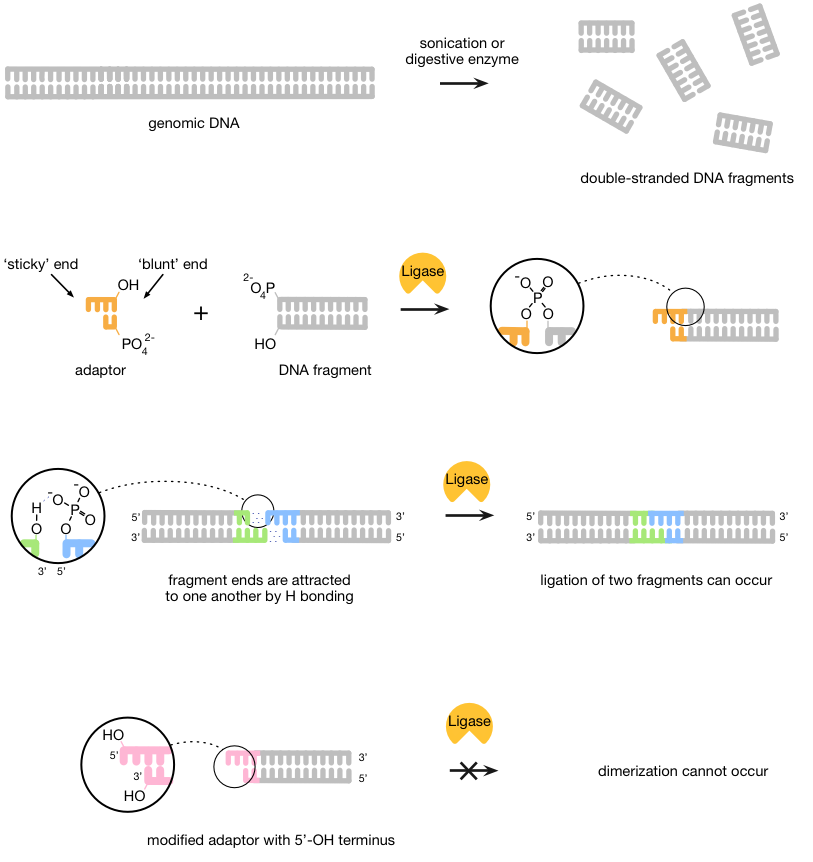
图1 | 新一代测序文库制备
为了测序是成功的,该文库片段需要在PCR菌落或'polonies“,因为它们是公知的,它包括一个特定的文库片段的许多拷贝的在空间上聚集。由于这些polonies附着在一个平面方式,所述阵列的特征可以酶促并行操纵。文库构建的这种方法比菌落采摘和大肠杆菌克隆的用于分离和扩增DNA为Sanger测序先前劳动密集型过程快得多,但是,这是在片段的读出长度为代价。
放大
文库扩增是必需的,以便从音序接收的信号是强到足以精确地检测。用酶扩增,可发生导致某些文库片段的优先扩增的现象,如“偏置”和“复制”。相反,有几种类型的扩增过程的其中使用的PCR来创建大量的DNA簇。
乳液PCR
乳液油,珠,PCR混合物和文库DNA混合以形成这导致微孔(形成的乳液图2)。
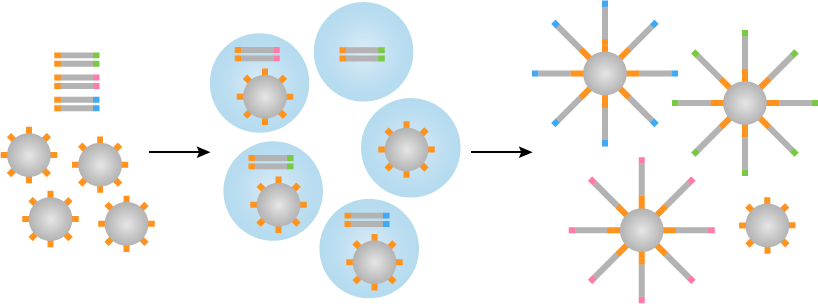
图2 | 乳液PCR
为了使测序过程是成功的,每个微井应包含一胎圈与DNA的一条链(微井的约15%是该组合物的)。在PCR然后变性的文库片段领先两个单独的链,其中(反向链)之一退火至珠粒。退火的DNA通过聚合酶从朝向引物位点的珠开始扩增。原始反向链然后变性,并从胎圈只有重新退火释放到珠,得到两个分开的链。这些都被扩增,得到附着在胎圈两条DNA链。该处理然后在30-60个循环导致DNA的簇重复。这种技术已经被批评为耗时的性质,因为它需要很多步骤(成型和破乳,PCR扩增,浓缩等),尽管它在许多的NGS平台的广泛使用。这也是相对低效的,因为只有两个周围三分之二乳液的微反应器实际上将包含一个珠子。因此,一个额外的步骤是必需的空系统,从而导致更多的潜在不准确分离。
大桥PCR
流动池的表面上密集地涂覆有对附着在DNA文库片段(引物互补的引物如图3)。然后将DNA连接到随机的细胞的表面上,其中它暴露于试剂用于基于聚合酶延伸。在加入核苷酸和酶,DNA的单链的自由端附着在经由互补的引物的细胞的表面上,形成桥接结构。酶,然后用桥相互作用,使它们的双链,这样,当变性发生时,两个单链DNA片段连接到在靠近表面。这一过程的重复导致局部相同链的克隆簇。为了优化集群密度,试剂浓度必须密切监控,以避免过度拥挤。
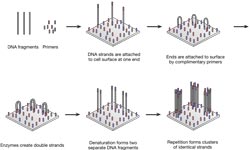
图3 | 桥接PCR
测序
新一代测序的几个竞争方法已经由不同的公司开发的。
454焦磷酸测序
焦磷酸测序是基于“测序通过合成”的原则,在互补链在聚合酶(的存在下合成的图4)。相反,使用双脱氧核苷酸终止链的扩增(如在Sanger测序),焦磷酸测序代替检测何时核苷酸加到DNA链焦磷酸的释放。它最初使用乳液PCR技术来构建用于测序所需的polonies并移除互补链。接着,将单链DNA的测序引物杂交到链(引物结合区)的端部,则四种不同的dNTP,然后依次制成在polonies进出井流动。当正确的dNTP被酶纳入链,它会导致焦磷酸盐的释放。在ATP硫酸和腺苷的存在下,将焦磷酸转化为ATP。这项ATP分子用于荧光素荧光素酶催化转化为氧化萤光素,它产生可与相机被检测的光。光的相对强度正比于加入的碱的量(即两倍的强度的峰值表示两个相同的碱基相继增加了)。
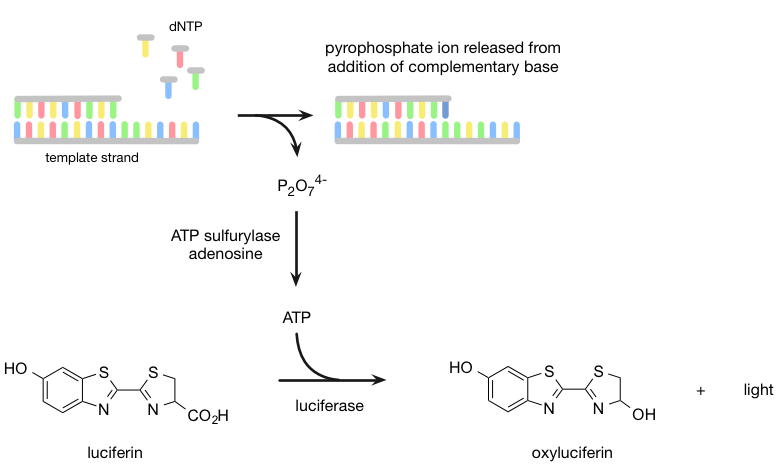
图4 | 454焦磷酸测序
焦磷酸测序,由454生命科学公司研制,是新一代测序的早期成功之一; 的确,454生命科学公司生产的第一个商用的下一代音序器。然而,该方法是由其他技术黯然失色,并在2013年,新业主罗氏宣布454生命科学的关闭和454焦磷酸测序平台停产。
离子洪流半导体测序
离子洪流测序采用了“测序通过合成”的方式,在一个新的DNA链,目标链互补,在一次合成一个碱基。一种半导体芯片检测的DNA聚合(期间产生的氢离子图5)。
以下使用乳液PCR聚合酶群落的形成,DNA文库片段被顺序地充斥各三磷酸核苷(的dNTP),如焦磷酸测序。则的dNTP掺入新链如果互补的靶链的核苷酸。每个成功添加的核苷酸的时候,氢离子被释放出来,并且它由定序器的pH传感器检测到。如在焦磷酸测序方法中,如果被加入相同的核苷酸的一个以上,在pH值/信号强度的变化是相应较大。
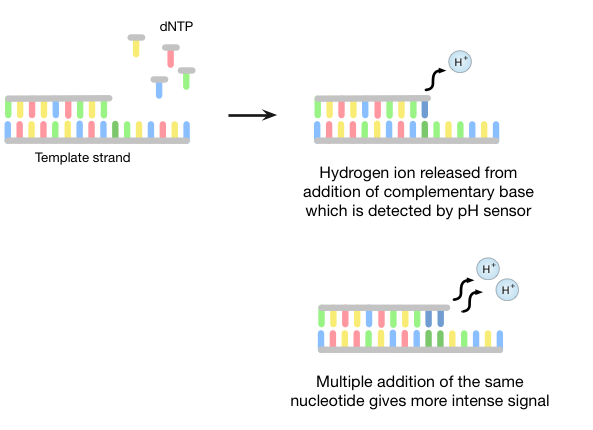
图5 | 离子洪流半导体测序
离子洪流测序是第一个商业化的技术不使用荧光和摄像头扫描; 它因此比许多其他方法更快和更便宜。不幸的是,它可能难以枚举加入相同的碱基数连续。例如,可能难以区分pH变化为长度9的homorepeat长度10的一个,使得难以重复序列进行解码。
通过连接测序(固体)
固体为测序的酶方法,使用DNA连接酶,在生物技术广泛用于其结扎双链DNA链的能力(一种酶图6)。乳液PCR用于以固定/放大已上的珠子结合到靶序列(即是序列待测序)一个单链DNA引物结合区(称为适配器)。然后,这些珠粒沉积到玻璃表面-珠的高密度,可以实现这反过来,增加了该技术的吞吐量。
一旦珠沉积发生,长度为N的引物杂交到适配器,则珠粒暴露于具有在5种不同的荧光染料'端和3羟基'端8聚体探针的文库。基地1和2是对核苷酸互补,而碱基3-5待测序是简并碱基6-8是肌苷碱基。只有一个互补的探针将杂交到靶序列邻近于引物。DNA连接酶是随后使用的8聚体探针加入到引物。碱基5和6之间的硫代磷酸酯连接允许荧光染料从使用银离子的片段被裂解。这个裂解允许测量荧光(四种不同的荧光染料的使用,所有这些都具有不同的发射光谱),并还产生可经历进一步结扎5'-磷酸基。一旦第一轮测序完成,延伸产物被熔化掉,然后进行第二轮测序是perfomed与长度为N-1的引物。测序的多轮使用较短的引物各时间(即N-2,N-3等),并测量荧光确保目标被测序。
由于两碱基测序方法(因为每个基被有效地测序两次),固体技术是高度准确的(在含有第六底漆99.999%,这是最精确的第二代平台),也便宜。它可以在7天的时间可以产生数据的30 GB完成一次运行。不幸的是,它的主要缺点是,读取长度短,使得它不适合于许多应用。
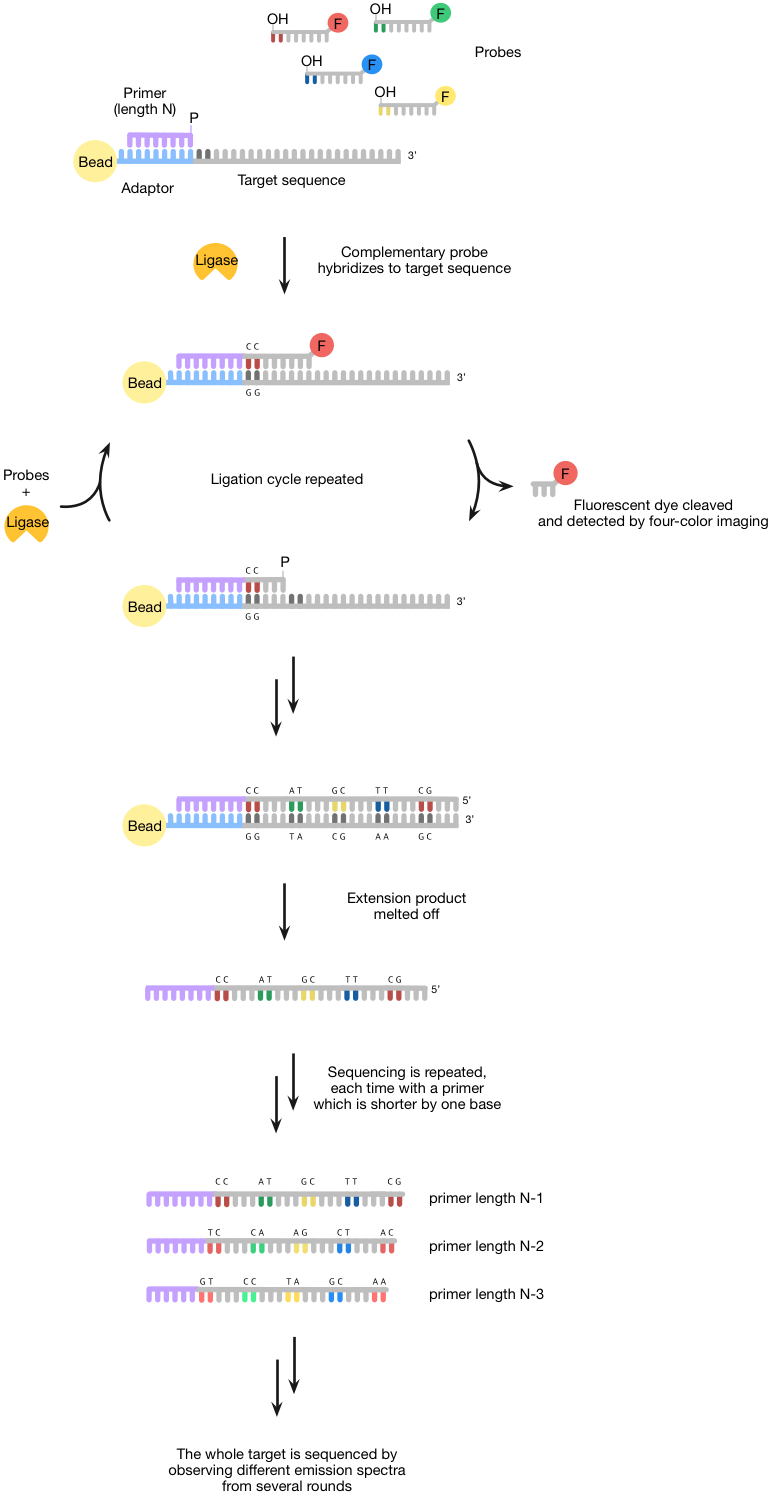
图6 | 测序结扎
可逆终止子测序(Illumina公司)
可逆终止子测序从在传统的Sanger法的不同,而不是终止不可逆地使用双脱氧核苷酸的引物延伸,修饰的核苷酸在可逆终止使用。而许多其它技术使用乳液PCR来扩增该DNA文库片段,可逆终止使用桥的PCR,提高该工艺阶段的效率。
可逆的终止子可分为两类:3'-O-阻断可逆终止子和3'-畅通可逆终止子。
3'-O-阻断可逆终止子
该机构通过合成方法使用测序,拉长以逐步的方式的引物。首先,测序引物和模板固定于固体支持物。支撑暴露于四个DNA碱基,其具有除了一个3'-O-叠氮基连接(到含氮碱)不同的荧光团(的图7)。
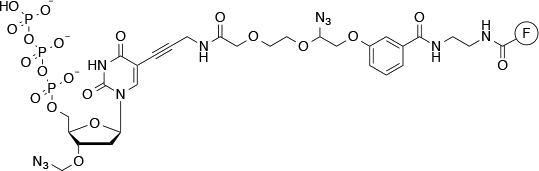
图7 | 在Illumina的测序使用结构荧光标记的dNTP
只有正确的碱基退火至目标,并随后连接到引物。然后将固体载体进行成像并且尚未掺入的核苷酸被冲走和荧光分支使用的TCEP(三(2-羧乙基)膦)裂解。TCEP还删除3'-O-叠氮基,再生的3'-OH,循环可以重复(图8)。
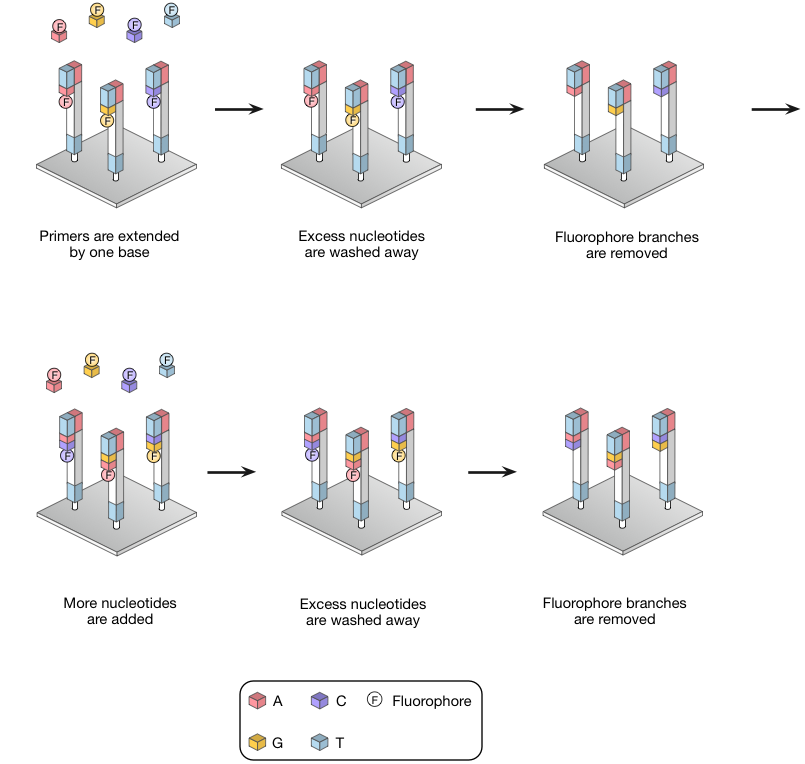
图8 | 可逆终止测序
3'-畅通可逆终止
的3'-畅通可逆终止子的可逆终止基团连接到基极和荧光基团,它现在作为终止基团的一部分,以及作为记者两者。此方法从3'-O-阻断可逆终止子方法的不同之处有三种:第一,3'-位没有被阻塞(即基座具有游离的3'-OH); 荧光团是所有四种碱基相同; 和每个修改碱的顺序,而不是在同一时间流。
这些技术的主要缺点在于它们的差读出长度,这可以通过两个现象之一引起的。为了防止两个核苷酸的掺入在一个单一的工序中,一个块到位,但在没有嵌段加成的情况下,由于差的合成,股线可以成为相创建这限制了读出长度的噪声进行。如果荧光团没有被成功连接或移除噪声也可以被创建。这些问题是在其他测序方法盛行,并且是主要限制因素读取长度。
该技术是由Illumina公司首创,用自己的HiSeq和MiSeq平台。HiSeq是最便宜的为每百万个碱基0.02 $成本的第二代测序仪的。它还具有600 GB的每个输出高位运行数据需要大约8天的时间完成。
第三代测序
技术的新世代以来一直使用单分子测序和单实时测序的发展,消除对克隆扩增的需要。这减少了由PCR错误,简化了库制剂,以及最重要的是,使用更高的吞吐量平台高得多的读出长度。实例包括太平洋Biosciences的平台,它使用SMRT(单分子实时)测序,得到一个约一千个碱基和Helicos Biosciences公司利用单分子测序,因此并不要求事先测序扩增读长。牛津纳米孔技术目前正在开发其受到改变作为DNA穿过孔的电流硅基纳米孔。这预计是DNA测序的高通量快速的方法,尽管如通过孔减缓交通问题必须首先解决。
测序表观遗传修饰
正如新一代测序使基因测序大规模,现在已经很清楚最近,遗传密码不包含有机物所需的所有信息。表观遗传修饰的DNA碱基,特别是5-甲基胞嘧啶,也传达重要信息。
所有的第二代测序平台依赖,如Sanger测序,PCR的,因此无法序列修饰的DNA碱基。实际上,无论是5-甲基胞嘧啶和5-羟甲基被视为由参与的PCR酶胞嘧啶; 因此,表观遗传信息测序过程中丢失。
亚硫酸盐测序
亚硫酸盐测序利用了胞嘧啶和5-甲基胞嘧啶相对于亚硫酸氢盐的反应性的差异:胞嘧啶亚硫酸氢脱氨,形成尿嘧啶(测序时,其内容为T),而5-甲基胞嘧啶是反应性(即读为C)。如果两个测序运行并行,一个有亚硫酸氢盐处理和一个没有,完成了两次运行的输出之间的差异表明,在原始序列甲基化的胞嘧啶。这种技术还可以用于双链DNA,因为用亚硫酸氢处理后的链不再互补,并且可以被视为单链DNA。
5-羟甲基,另一个重要的表观遗传修饰,反应用亚硫酸氢形成胞嘧啶-5-甲基磺酸盐(为C测序时其内容)。这有点复杂事务,并且意味着亚硫酸氢盐测序不能用作甲基化的本身就是一个真实指示器。
氧化亚硫酸氢盐测序
氧化亚硫酸氢盐测序添加化学氧化步骤,其中使用氢过钌酸铵,KRuO4,亚硫酸氢盐处理前5-羟甲基转化为5- formylcytosine。5- Formylcytosine被deformylated和脱氨基,以形成由亚硫酸氢盐处理尿嘧啶。现在,三个独立的测序运行是必要区分胞嘧啶,5-甲基胞嘧啶和5-羟甲基(参见图9)。
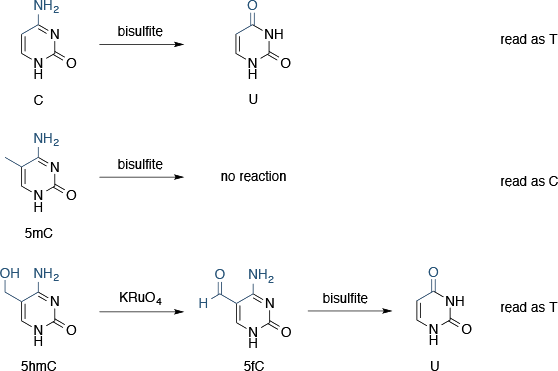
图9 | 利用测序表观遗传修饰的亚硫酸氢
新一代测序中的应用
新一代测序已使研究人员能够收集数量庞大的基因测序数据。这种技术具有的应用,如过多:诊断和了解复杂疾病; 全基因组测序; 表观遗传修饰的分析; 线粒体测序; 转录组测序 - 了解基因变异如何表达改变影响到一个有机体; 和外显子测序 - 在外显子组突变被认为含有高达90%的突变在人类基因组,从而导致疾病。DNA技术已被用于鉴定和分离负责某些疾病的基因,并且提供被称为“基因疗法”有缺陷的基因的正确副本。
在基因治疗中大焦点区域是癌症治疗-一种可能的方法是引进的反义RNA(其特异性地防止靶蛋白的合成)向癌基因,这是触发以形成肿瘤细胞。另一种方法被命名为“自杀基因疗法”它引入基因来杀死癌细胞选择性。毒性的蛋白质和酶的许多遗传密码是已知的,和引入这些基因进入肿瘤细胞会导致细胞死亡。在此方法的困难在于确保非常精确的递送系统,以防止杀死健康细胞。
这些方法成为可能通过测序来分析肿瘤的基因组,从而使医学专家能够更有效地定制化疗和其它癌症的治疗,以病人的独特遗传组成,彻底改变个性化医疗的诊断阶段。
随着DNA测序成本下降,这将变得更加普遍,这带来了一些问题。测序产生大量数据,并且有与处理和存储的数据相关联的许多计算挑战。也有伦理问题,诸如个人的DNA的所有权时,DNA被测序。DNA测序数据必须安全地存储,因为有一些保险集团,抵押贷款经纪人和雇主可以使用这些数据来修改保险报价或候选人区分的担忧。测序也可能有助于找出个体是否具有增加的风险的特定疾病,但病人是否被通知或者如果有这种疾病的治疗是另一个问题完全。
